Oi pessoas desculpem a demora, mas eu acabei perdendo o pique em postagens( para ser honesto, esses dias foram terríveis para minha rotina de estudante...), mas tudo bem hoje vou postar sobre dissociação e ionização e também vou da introdução aos ácidos. O post de dissociação vai estar meio pobre, pq estou sem livros para consultar em caso de duvida, mas ao chegar em casa eu conserto (ou não)....
PROCESSO DE DISSOCIAÇÃO...
 Bem vamos nos basear em Arrhenius, já que sua teoria ( e experiencias) foi a melhor acolhida...
Bem vamos nos basear em Arrhenius, já que sua teoria ( e experiencias) foi a melhor acolhida...
Segundo experiencias realizadas por Arrhenius, algumas substancias quando em meio aquoso, água, transformava este meio em uma solução eletrolítica, que conduzia eletricidade. Então, através disso, Arrhenius concluiu que a solução em questão era provida de íôns (partículas carregadas positivamente ou negativamente).
A teoria dizia que substâncias iônicas e algumas moleculares ( ácidos e bases) em meio aquoso se dividiam em particulas condutoras de corrente...

Exemplo da dissociação iônica do NaCℓ em água: A água é uma substância constituída por moléculas polares, o pólo negativo está situado no átomo de oxigênio e o pólo positivo está nos átomos de hidrogênio. A solução iônica é obtida da interação entre H2O e NaCℓ.
... E DE IONIZAÇÃO
Já a ionização, também comprovada por Arrhenius, dizia que alguns compostos moleculares poderiam sofrer ionização, ou seja, as ligações covalentes entre os átomos se rompiam e liberavam cátions e ânions, como no caso dos ácidos e bases. Porem, existem também moléculas que não liberavam íons, apenas se DISSOLVIAM na água.
EX:
PROCESSO DE DISSOCIAÇÃO...
 Bem vamos nos basear em Arrhenius, já que sua teoria ( e experiencias) foi a melhor acolhida...
Bem vamos nos basear em Arrhenius, já que sua teoria ( e experiencias) foi a melhor acolhida...Segundo experiencias realizadas por Arrhenius, algumas substancias quando em meio aquoso, água, transformava este meio em uma solução eletrolítica, que conduzia eletricidade. Então, através disso, Arrhenius concluiu que a solução em questão era provida de íôns (partículas carregadas positivamente ou negativamente).
A teoria dizia que substâncias iônicas e algumas moleculares ( ácidos e bases) em meio aquoso se dividiam em particulas condutoras de corrente...

Exemplo da dissociação iônica do NaCℓ em água: A água é uma substância constituída por moléculas polares, o pólo negativo está situado no átomo de oxigênio e o pólo positivo está nos átomos de hidrogênio. A solução iônica é obtida da interação entre H2O e NaCℓ.
... E DE IONIZAÇÃO
Já a ionização, também comprovada por Arrhenius, dizia que alguns compostos moleculares poderiam sofrer ionização, ou seja, as ligações covalentes entre os átomos se rompiam e liberavam cátions e ânions, como no caso dos ácidos e bases. Porem, existem também moléculas que não liberavam íons, apenas se DISSOLVIAM na água.
EX:
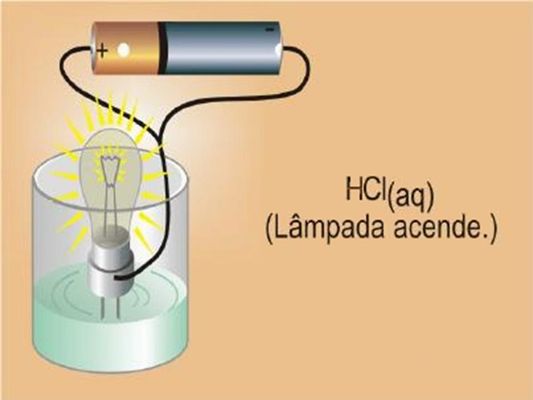
Arrhenius atentou para os seguintes fatos ao experimentar a condutividade de compostos moleculares, como o açúcar (C12H 22O 11) e o ácido clorídrico (HCℓ), e concluiu que:
• Na solução aquosa de açúcar não existe íons, por não conduzir corrente elétrica. Sendo assim, o açúcar dissolveu somente na água.
• Confirmou a existência de íons livres, devido à condução de corrente elétrica pela solução aquosa de ácido clorídrico.
O HCℓ é um composto constituído por moléculas, sendo assim os íons são formados mediante a quebra dessas moléculas pela água. Esse fenômeno é designado ionização.
• Na solução aquosa de açúcar não existe íons, por não conduzir corrente elétrica. Sendo assim, o açúcar dissolveu somente na água.
• Confirmou a existência de íons livres, devido à condução de corrente elétrica pela solução aquosa de ácido clorídrico.
O HCℓ é um composto constituído por moléculas, sendo assim os íons são formados mediante a quebra dessas moléculas pela água. Esse fenômeno é designado ionização.

Ah, só para adiantar... A força de um ácido e base, também é medido através da capacidade de condução da substancia.
Forte, caso a intensidade do brilho da lampada seja forte, fraca caso o brilho seja fraco e moderado (bem esse esta em meio termo né?)
fontes:





















